新冠病毒席卷全球造成了公共卫生与安全的重大威胁[1]。SARS-CoV-2病毒的基因组RNA被包裹在由四种结构蛋白组成的病毒颗粒内,这四种结构蛋白分别是冠状突刺糖蛋白、膜蛋白、离子通道包膜蛋白和核衣壳蛋白(Nucleocapsid protein,SARS2-NP)。刺突蛋白与人类ACE2受体结合,负责病毒进入宿主细胞;膜蛋白促进病毒在内质网的组装;而SARS2-NP与病毒RNA组装形成螺旋状核糖核蛋白复合体,形成称为核衣壳的结构。SARS2-NP具有自组装特性,其中包含一个二聚化的结构域,该结构域对于NP蛋白二聚化以及C末端介导的四聚体形成非常关键。但是目前SARS2-NP除了对于病毒RNA包装非常关键以外是否还具有其他致病机制以及其自组装特性是否能够用于COVID-19的防治尚不清楚。
2021年7月8日,苏州大学周芳芳研究组在Nature Cell Biology杂志上发表文章Targeting liquid-liquid phase separation of SARS-CoV-2 nucleocapsid protein promotes innate antiviral immunity by elevating MAVS activity,揭开了SARS2-NP蛋白介导先天免疫逃逸、蛋白翻译后修饰以及突变的相关机制,为优化COVID-19的治疗策略以及抗病毒药物的筛选提供了新的可能。

SARS2-NP蛋白包三个已知可能的内在无序序列(Intrinsically disordered regions,IDRs),还有一个N端的RNA结合结构域以及C端的一个二聚化结构域[2]。考虑到IDRs区域是蛋白能够发生液-液相分离的关键特征,作者们想知道SARS2-NP蛋白是否具有液-液相分离活性。作者们发现,体外纯化的SARS2-NP蛋白可以形成液滴(图1),而该液滴可以被破坏弱疏水相互作用力的药物1.6-Hex(1,6-hexanediol)所破坏,同时该液滴在光漂白之后可以快速恢复,说明SARS2-NP的确具有发生液-液相分离的能力(关于新冠病毒N蛋白相分离的相关内容,此前有一些报道,详见:Protein & Cell | 曾坚阳/李丕龙团队合作提出基于相分离的新冠联合用药新策略)。
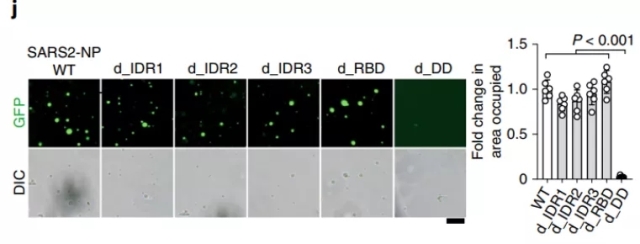
图1 SARS2-NP具有液液想分离活性且该活性依赖于其二聚化结构域
随后为了揭开SARS2-NP中对于相分离活性的关键区域,作者们构建了一系列SARS2-NP的短截形式。作者们发现,无论是删除不同的IDRs还是NP蛋白中的RNA结合结构域对于其体外液滴形成的能力都没有显著地影响,但是在删除其二聚化的结构域后其体外液滴形成的能力则明显降低(图1)。通过表面等离子共振技术,作者们发现SARS2-NP蛋白的二聚化区域对于其结合病毒的RNA非常关键。
进一步地,为了探讨NP蛋白在先天性抗病毒应答中的作用,作者们将SARS2-NP表达在细胞之中,发现SARS2-NP负调控IFN-β信号通路,而删除其二聚化结构域后则会显著影响其抑制作用。因此,SARS2-NP蛋白的二聚化结构域正是介导先天性免疫应答抑制的关键。通过构建小鼠模型,作者们又进一步在体内模型中证明了,SARS2-NP蛋白中其二聚化结构域对其介导的天然抗病毒应答的抑制是必不可少的。
随后,作者们通过评估病毒诱导的TBK1和IRF3的磷酸化以及IRF3的二聚化及其在核内的累积来探究NP蛋白是否通过抑制IFN-β信号转导来抑制先天的免疫途径。作者们发现SARS2-NP蛋白野生型而非二聚化结构域删除型能够靶向IFN-β信号通路中TBK1-IRF3上游组分。进一步地,作者们发现SARS2-NP蛋白通过结合MAVS并干扰其相分离,负调控MAVS-IRF3信号级联途径。SARS2-NP蛋白的表达会抑制MAVS的泛素化修饰,而二聚化删除的形式的抑制能力则会显著受到影响。因此,SARS2-NP蛋白会抑制MAVS的激活。
这些发现进一步引出了一个新的问题,即大量NP蛋白存在的情况下宿主是如何对病毒感染进行防御的,作者们猜测NP蛋白本身在宿主体内可能也会被调控。作者们通过对NP蛋白感染小鼠的组织进行质谱分析后发现,SARS2-NP蛋白的Lys375位点会被高度乙酰化(图2)。为了验证该乙酰化状态的作用,作者们构建了持续模拟乙酰化的突变,该突变引入后会显著抑制NP的活性。而将该乙酰化位点进行突变后,则会显著提高NP蛋白结合RNA的能力。通过构建特异性的NP乙酰化抗体以及遗传密码正交系统实验,作者们证实了NP蛋白乙酰化后的确会造成活性的降低,而且乙酰化的NP蛋白相分离的能力也会明显下降
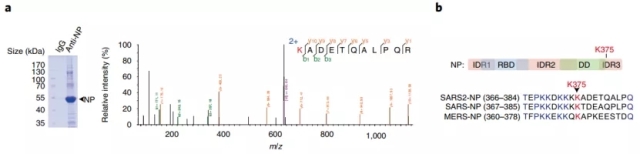
图2 SARS2-NP蛋白的Lys375位点被高度乙酰化
最后,作者们筛选出了一种靶向SARS2-NP蛋白二聚化结构域的多肽,该多肽可以破坏了SARS2-NP的液-液相分离液滴,并在体外和体内均证明能够抑制SARS-CoV-2病毒的复制和拯救先天的抗病毒免疫缺陷。
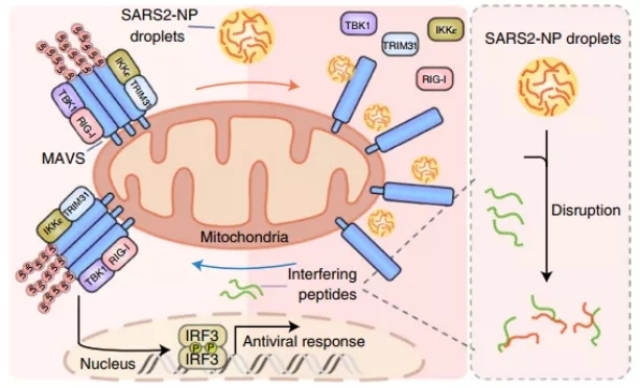
图3 工作模型
总的来说,该工作鉴定发现了SARS2-NP蛋白具有发生液液相分离的能力,同时其中的二聚化结构域对于其相分离活性非常关键(图3)。另外,作者们还鉴定发现了NP蛋白中包含的高度乙酰化的位点,该位点的模拟乙酰化突变会破坏SARS2-NP蛋白的液-液相分离能力。该发现证明SARS2-NP蛋白的相分离活性可以作为新冠病毒感染后可能的治疗靶点,为相关的药物开发提供了新的可能。
(来源:BioArt)
参考文献:
Li, J. et al. Clinical features of familial clustering in patients infected with 2019 novel coronavirus in Wuhan, China. Virus research 286, 198043, doi:10.1016/j.virusres.2020.198043 (2020).
2. Ye, Q., West, A. M. V., Silletti, S. & Corbett, K. D. Architecture and self-assembly of the SARS-CoV-2 nucleocapsid protein. Protein science : a publication of the Protein Society 29, 1890-1901, doi:10.1002/pro.3909 (2020).
链接:https://mp.weixin.qq.com/s/TJBR_VukSdMkpbO_QUurCg

